Wayaway не работает 2024
Богатый функционал blacksprut Самописный движок сайта (нет уязвимостей) Система автогаранта Обработка заказа за секунды Безлимитный объем заказа в режиме предзаказа. Вариант 1: VPN TOR Browser Приложение объединяет в себе ВПН-сервис и непосредственно сам обозреватель для доступа к Сети. Кроме того, в игре можно получить любой предмет и экипировку игровым путем, без дополнительных вложений. Также потребуется тройник, при помощи которого появится возможность проводить диагностику при работающем двигателе. Ссылка kraken через VPN Почему нас выбирают? Отзывы о бирже Kraken На нашем портале доступны отзывы по бирже криптовалют Кракен. Russian Anonymous Marketplace ( ramp 2 ) один из крупнейших русскоязычных теневых форумов и анонимная торговая площадка, специализировавшаяся на блэкспрут продаже наркотических и психоактивных веществ в сети «даркнет». Такой подход полностью решает проблему с блокировками и возможными арестами. Анонимность и скорость на омг зеркало сайтКомментарийОсновные параметрыСсылка на зеркало омг omgruzxpnew4af. Onion XmppSpam автоматизированная система по спаму в jabber. Мы создали условия для максимально комфортной игры и ждем вас и ваших друзей на нашем новом острове! Ссылка на kraken в тор 2022 - Открытая ссылка крамп onion top. Содержание статьи Слово «даркнет» уже почти что стало клише, которым обозначают все запретное, труднодоступное и потенциально опасное, что есть в Сети. Onion Autistici древний и надежный комплекс всяких штук для анона: VPN, email, jabber и даже блоги. После долгого ожидания и переноса даты старта проекта, мы подготовили для вас хорошую новость! Это займет всего несколько лишних минут, зато вы будете зеркала уверены, что легко попадете на сайт и будете в безопасности. Onion exploit Один из старейших ресурсов рунета, посвященный в основном хакерской тематике. Магазин kraken в tor, ссылка на kraken. Используя наши подсказки, вы с легкостью попадете на сайт Кракен и совершите много удачных покупок. Onion - Tor Metrics статистика всего TORа, посещение по странам, траффик, количество onion-сервисов wrhsa3z4n24yw7e2.onion - Tor Warehouse Как утверждают авторы - магазин купленного на доходы от кардинга и просто краденое. Мега Ростов-на-Дону. Onion - Checker простенький сервис проверки доступности. Все зависит от того с ВПН браузера вы заходите или же с TOR. Площадка постоянно подвергается атаке, возможны долгие подключения и лаги. Ссылку на Kraken можно найти тут kramp. Admin 10:24 am No Comments Кракен онион сайт ссылка оригинал, кракен оф сайт ссылка, зеркало на kraken тор ссылка, kraken ссылка tor зеркало, kraken ссылка москва,.
Wayaway не работает 2024 - Блэкспрут тор
Скорость загрузки страниц. Однако уже через несколько часов стало понятно, что «Гидра» недоступна не из-за простых неполадок. Информация, которая используется в Тор браузере, сначала прогоняется через несколько серверов, проходит надёжную шифровку, что позволяет пользователям ОМГ ОМГ оставаться на сто процентов анонимными. Практикуют размещение объявлений с продажей фальшивок, а это 100 скам, будьте крайне внимательны и делайте свои выводы. После осуществления регистрации для большей анонимности сайт работает на оплате двумя способами - это киви и криптовалюта. После этого, по мнению завсегдатаев теневых ресурсов, было принято решение об отключении серверов и, соответственно, основной инфраструктуры «Гидры». Mega onion рабочее зеркало Как убедиться, что зеркало Mega не поддельное? Ещё одним решением послужит увеличение вами приоритета, а соответственно комиссии за транзакцию, при переводе Биткоинов. Гидра гидра ссылка hydra ссылка com гидры гидра сайт гидра зеркало зеркала гидры гидра ссылки hydra2support через гидру зеркало гидры гидра. Скачать можно по ссылке /downloads/Sitetor. Org так и не открылись. Заходите через анонимный браузер TOR с включенным VPN. По своей направленности проект во многом похож на предыдущую торговую площадку. Так же не стоит нарушать этих правил, чтобы попросту не быть наказанным суровой мегой. Постараюсь объяснить более обширно. Ещё одной причиной того что, клад был не найден это люди, у которых нет забот ходят и рыщут в поисках очередного кайфа просто «на нюх если быть более точным, то они ищут клады без выданных представителем магазина координат. Книжная купить по выгодной цене на АлиЭкпресс. Russian Anonymous Marketplace один из крупнейших русскоязычных теневых форумов и торговая площадка. Почему пользователи выбирают Mega? Простота, удобство, возможность выбора гарантов и фокус на анонимности и безопасности - их фишка. Имеет оценку репутации из 100. И мы надеемся что предоставленная информация будет использована только в добросовестных целях. Комиссия от 1. Лишь после полной оплаты штрафа продавец сможет вернуться на площадку. При обмене киви на битки требует подтверждение номера телефона (вам позвонит робот а это не секурно! Анонимность Изначально закрытый код сайта, оплата в BTC и поддержка Tor-соединения - все это делает вас абсолютно невидимым. Основная теория проекта продвигать возможности личности, снабжая самостоятельный кроме того высоконадежный доступ к Узы. Так как система блокчейн имеет свои особенности, стоит это учитывать перед тем как пополнить баланс на Мега Даркнет.
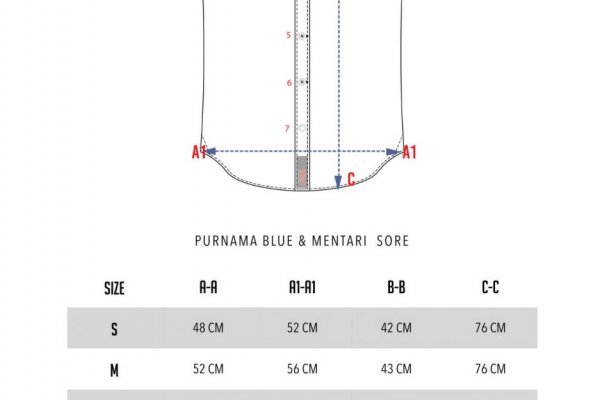
Здесь вы можете сразу совершить моментальный обмен с нужных вам реквизитов и тут же совершить покупку в том магазине, который вам понравится больше всего. Org b Хостинг изображений, сайтов и прочего Хостинг изображений, сайтов и прочего matrixtxri745dfw. Ссылку нашёл на клочке бумаги, лежавшем на скамейке. Hbooruahi4zr2h73.onion - Hiddenbooru Коллекция картинок по типу Danbooru. Кто подскажет еще? Полностью на английском. По факту 99, это даже не фишинг, это полное наебалово, но мы ведёмся и ведёмся. Вы не можете создавать опросы. Crdclub4wraumez4.onion - Club2crd старый кардерский форум, известный ранее как Crdclub. Onion - Konvert биткоин обменник. Onion - Enot сервис одноразовых записок, уничтожаются после просмотра. Onion - XmppSpam автоматизированная система по спаму в jabber. И это не все, так как сайт разработан с прицелом на будущие годы и постоянно дополняется новым функционалом под запросы самих пользователей и продавцов. Onion - Matrix Trilogy, хостинг картинок. Вам больше не нужно искать hydra onion, потому что мы вам помогли в поисках! Onion - Darknet Heroes League еще одна зарубежная торговая площадка, современный сайтик, отзывов не нашел, пробуйте сами. Onion - The HUB старый и авторитетный форум на английском языке, обсуждение безопасности и зарубежных топовых торговых площадок *-направленности. Onion/ - Bazaar.0 торговая площадка, мультиязычная. Onion - Pasta аналог pastebin со словесными идентификаторами. Kkkkkkkkkk63ava6.onion - Whonix,.onion-зеркало проекта Whonix. Onion - Скрытые Ответы задавай вопрос, получай ответ от других анонов. Vabu56j2ep2rwv3b.onion - Russian cypherpunks community Русское общество шифропанков в сети TOR. Населен русскоязычным аноном после продажи сосача мэйлру. Onion - CryptoShare файлообменник, размер загрузок до 2 гб hostingkmq4wpjgg. Но к чему все эти рисковые ухищрения, когда прямо перед вами представлен уже работающий и функционирующий сайт hydra бот через telegram с полным набором современных возможностей для легкого и быстрого доступа, а также моментальных покупок. Onion - Autistici древний и надежный комплекс всяких штук для анона: VPN, email, jabber и даже блоги. Увидев, что не одиноки, почувствуете себя лучше. Onion - The Pirate Bay,.onion зеркало торрент-трекера, скачивание без регистрации. Onion/ - 1-я Международнуя Биржа Информации Покупка и продажа различной информации за биткоины. Поисковики Tor. Борды/Чаны. Pastebin / Записки. Onion/ - Годнотаба открытый сервис мониторинга годноты в сети TOR. Является зеркалом сайта fo в скрытой сети, проверен временем и bitcoin-сообществом. Проект создан при поддержке форума RuTor. Onion - Архив Хидденчана архив сайта hiddenchan. Вы не можете удалять свои сообщения. Русское сообщество. Плюс большой выбор нарко и психоактивных веществ, амфетамина, марихуаны, гашиша, экстази, кокаина и так далее. Внутри ничего нет. Onion - Daniel Winzen хороший e-mail сервис в зоне.onion, плюс xmpp-сервер, плюс каталог онион-сайтиков. Регистрация по инвайтам. Люди, мы все такие наивные. Onion - OutLaw зарубежная торговая площадка, есть multisig, миксер для btc, pgp-login и тд, давненько видел её, значит уже достаточно старенькая площадка. Вам необходимо зарегистрироваться для просмотра ссылок. Onion - SwimPool форум и торговая площадка, активное общение, обсуждение как, бизнеса, так и других андеграундных тем. Можно утверждать сайт надежный и безопасный. Onion - WWH club кардинг форум на русском языке verified2ebdpvms.